质粒DNA的提取, 浓度测定, 成分测定
iGEM 实验的外行人的记录
生物和化学, 高中都没学. 为何还是头铁上了iGEM? 鬼知道, 好玩呗. 反正就是只要好玩的东西我都去试试.
但是毕竟是个外行人, 所以没法像行内人一样有那么多的行话. 只能够结合一点自己仅有的”普及”知识来记录一下我的第一次实验.
实验室的规范
生物实验和化学实验的不小心的后果的不同之处在于, 化学实验可以一下子就把你干掉, 生物实验可能要在接下来好几年里才把你给折磨死.
(惭愧, 虽然话是这么说, 但是我没有实验服… )
手套
主要有两个用处:
- 防止试验品被污染
- 防止我自己被干掉
手套有两种:
- 乳胶手套: 用来触碰实验仪器, 但是尽量不要戴着手套去开开关 (比如说开灯, 据说会被diss), 玩手机之类的
- 塑料手套: 进入”污染区”之后要带上, 所谓的污染区就是指操作核酸染料等的区域, (原因是核酸燃料的原理是和核酸结合, 可能就会和自己的核酸结合然后有致癌风险. ) (不用乳胶手套的原因是乳胶手套可能会破损)
垃圾桶
- 黄色: 按照上面的标记来扔
- 绿色蓝色: 纸和手套等
吃喝
你在想桃.
实验室内, 禁止吃喝.
实验仪器
灭菌锅
原理是通过蒸汽产生高温和高压环境.
实验室里面的使用很简单, 只要打开盖子, 确保有水, (查看水平线); 把要灭菌的东西放进去, 注意要把袋子扎紧, (因为高压); 然后把盖子合上, 把把手落下, 启动机器就可以自动了.
离心机
原理是通过高速旋转产生惯性离心力, 然后加速沉淀, 或者促进分离之类的.
实验室里的使用的时候要注意配平: 就是在悬臂两边要重量一致(让重心落在轴上), 假如不行的话, 就要加上配重(人工加上一个重物, 一般是一个装水的瓶子).
移液枪
高级吸管, 可以保证每次吸取的液体体积可控.
有一个旋钮, 可以用来调节吸取的体积, 这里要注意量程的选择.
枪头是可以换的, 绝对不要省.
吸取的时候不要有气泡, 因为这样会把这个量程搞混.
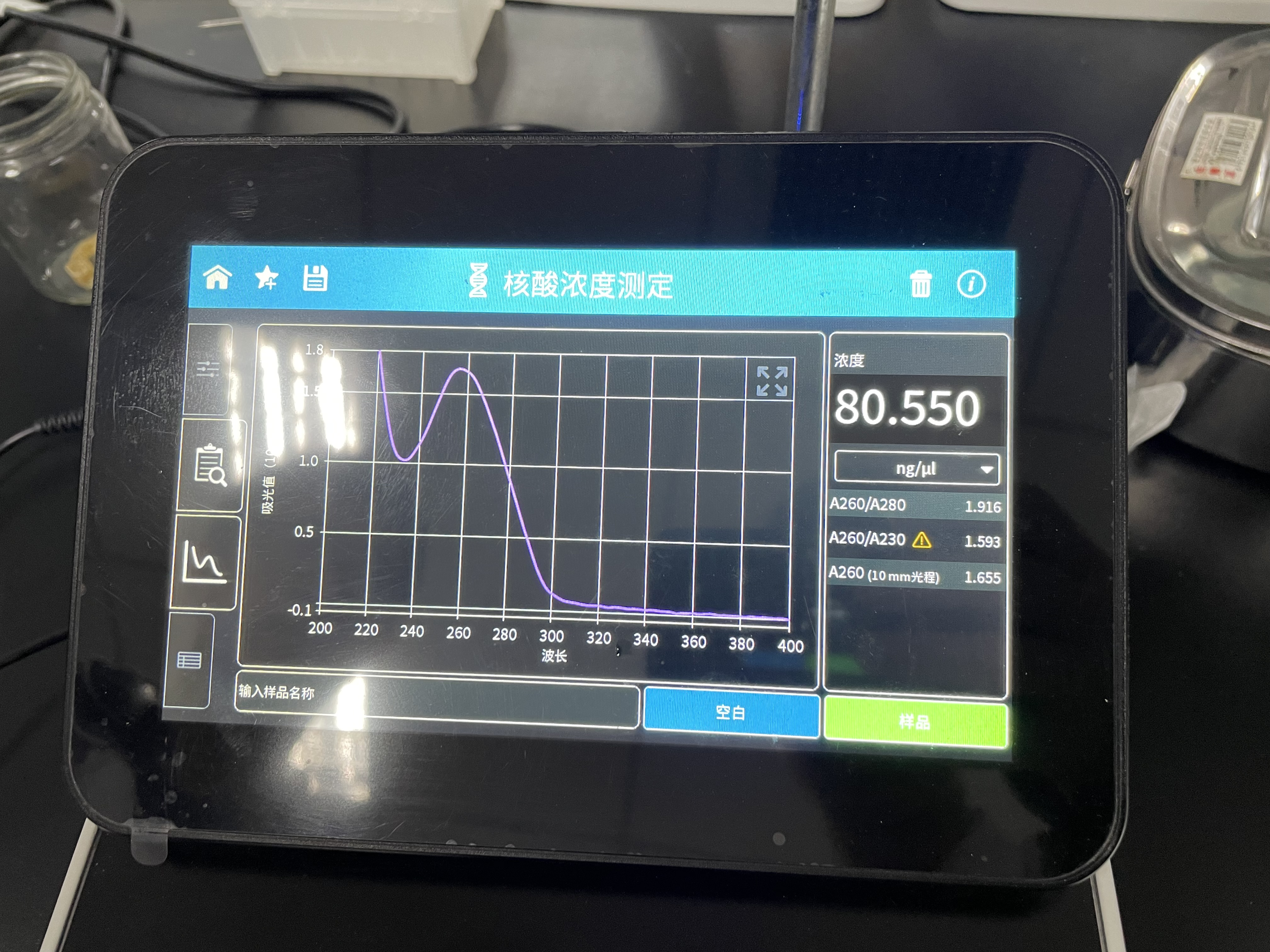
紫外分光分光度计
原理是不同的有机基团对光的吸收程度是不一样的, 这样可以用来区分RNA和DNA的浓度.
具体以后再深究吧… 有点懒得写了.
操作上的话, 注意这个是精密光学仪器, 不可以用手擦, 要用擦镜纸(因为不会掉毛之类的), 然后注意一个基准设置的问题. 虽然用水也可以, 但是还是用洗脱缓冲液最好.
然后操作上, 就是开机, 擦干净, 滴缓冲液测一个基准, 再擦干净测一次样品. 用完之后要擦干净, 并且还要关上盖子.
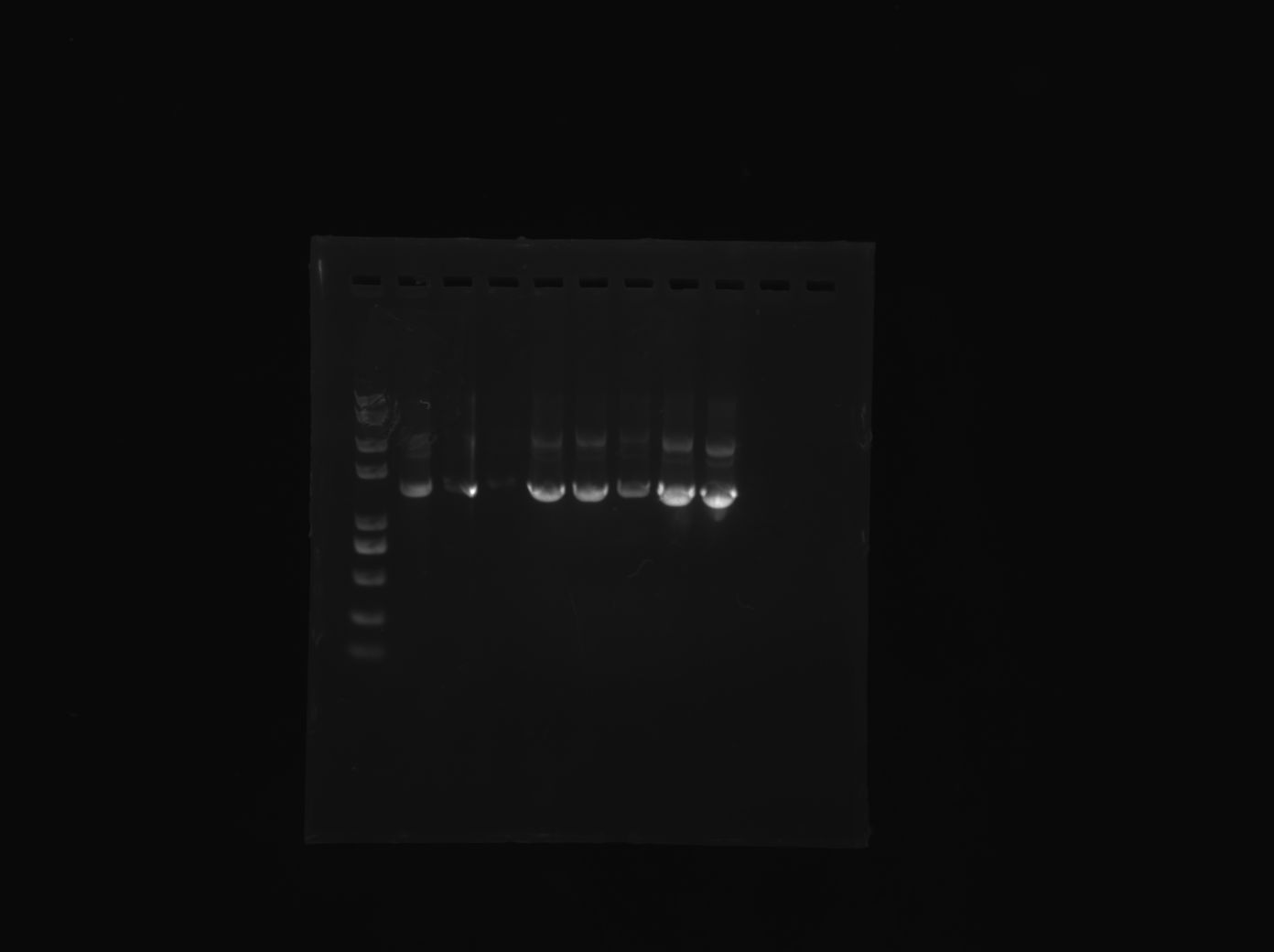
电泳
这一次不是我们配琼脂胶, 所以我不是很清楚.
原理上来说, 就是带电体在电场中会运动, 想法是让被测的物质带上足够大的电荷, 这样就和原来的电荷量无关了, 那么就可以有运动只与质量和形状有关了. (就是环状的质粒DNA会跑得快一点, 双链的线性DNA其次, 断开的DNA最慢. )
用的电压是110V, 大概跑到了胶的一半就可以收手了. 防止干烧.
提取质粒
(养细菌这些是不是我们干的, 而是我们的助教来养的. )
首先, 质粒这种东西应该是藏在细胞(细菌)内部的, 然后假如想要把它弄出来, 就要把细胞打爆.
(做实验之前一定要记得把东西标记好序号, 以免做的时候混在一起. )
| 试剂/材料 | 作用 |
|---|---|
| Buffer BL | 平衡液 |
| Buffer P1 | 重悬液 |
| Buffer P2 | 碱性溶液, 破坏细菌和让DNA变性 |
| Buffer P3 | 酸性溶液(醋酸), 为了得到高盐低PH环境 |
| Buffer PD | 除去蛋白质 |
| Buffer PW | 漂洗液 |
| Buffer TB | 洗脱缓冲液 |
| RNase A | RNA 酶 A |
| Filtration Columns CS | 过滤柱 |
| Spin Columns CP4 | 吸附柱 |
| Collection Tubes | 收集管 |
菌液处理
富集
- 菌液放在离心管中离心(12,000 rpm) 1min,
尽量吸除上清液.
这就是为了让菌体沉下来.菌液较多的时候可以通过多次离心来得到更多的菌体, 但是太多的菌体会裂解不充分, 会降低质粒提取效率.
(这个时候我发现了我们之前的实验的时候有一个问题, 就是没有把上清液给倒掉一部分, 这样就会导致我们后来的提取过程中的浓度不够, 因为这个时候, 细菌里面的要提取的东西 –DNA– 还是在底下的沉淀里面的. )
- (先加入
RNase A)
(学长帮我们做了的, 所以我们做的时候没有这一步.)Ribonuclease (commonly abbreviated RNase) is a type of nuclease that catalyzes the degradation of RNA into smaller components.
来自维基百科 - 往离心管中加入 500 μl
P1(重悬液), 将菌液重悬.
就是让菌体重新在溶液中均匀分布, 有更好的和溶液的接触, 然后就可以更好地裂解.假如不能够混匀, 会影响裂解.
- (这个时候我们把混匀的菌液转移到一个小一点的离心管中, 因为后面的操作的离心机不够大.)
裂解
- 向离心管中加入 500 μl
P2(碱性, 用来裂解), 温柔地上下翻转6-8次, 使菌体充分裂解.不要剧烈震荡的原因是为了防止打断基因组DNA, 这个时候菌液应该会变得清亮粘稠.
因为这个时候的菌体裂开了, 就看起来不是很浑浊了.
(菌体: 我裂开来… )
去掉基因组DNA
- 向离心管中加入700 μl溶液
P3(酸性中和液), 立即温和地上下翻转6-8次, 充分混匀, 此时会出现白色絮状沉淀.
(这是因为不同的DNA恢复原装(复性)的速度不一样, 小的质粒DNA复性得比较快, 复杂的基因组DNA复性的慢, 甚至相比之下是无穷久的. 然后基因组DNA因为是长链, 容易和蛋白质缠在一起, 形成沉淀. 质粒DNA是环状的.)假如没有立刻混合的话, 就会在上面就形成沉淀了, 那么后果就会导致离心失败. (我看到另外一组虽然离心了, 但是因为可能是局部沉淀的原因, 离了心之后还是上面浑浊, 没有分离的样子. )
得到初步的质粒DNA的溶液
- 离心 12,000 rpm 10 min
管底会生成沉淀. (应该就是把基因组DNA给取掉. ) 然后取上清液.这个时候, 假如还有微小的白色沉淀, 就再次离心.
(这个时候上清液里面的成分应该就是质粒DNA, 还有一些蛋白质之类的东西. )
柱吸附
柱平衡 - 对吸附柱预处理
- 向
CP4中放入平衡液BL, 离心(12,000 rpm) 1min
柱吸附
- 将上清液分次(防止太多装不下)加入过滤柱
CS, 离心 12,000 rpm, 2min. - 取离心后的溶液到吸附柱
CP4中, 离心 12,000rpm 2min - (重复上面的操作, 让上清液全部走完)
这个部分的操作是为了让质粒DNA可以吸附到吸附柱上. (吸附的条件: 高盐低PH吸附, 反之释放. )
去掉蛋白质
- 向吸附柱
CP4中加入500 μl去蛋白液PD, 离心 12,000 rpm 1min
(这个是为了把蛋白质给去掉. )
漂洗
- 向吸附柱
CP4中加入600 μl漂洗液PW(之前要加入无水乙醇, 但是还是学长帮我们准备好了. ) 离心 12,000 rpm 1 min - 重复上一步
- 再将空收集管离心12,000rpm 2min
把残余的漂洗液去除.
注意: 漂洗液中乙醇的残留会影响后续的酶反应 (酶切, PCR等)实验. 为确保下游实验不受残留乙醇的影响, 建议将吸附柱CP4开盖, 置于室温放置数分钟, 以彻底晾干吸附材料中残余的漂洗液.
收集
- 将吸附柱CP4置于一个干净的离心管中,
向吸附膜的中间部位悬空滴加100-300μl洗脱缓冲液
TB, 室温放置2 min, 离心12,000 rpm 1 min, 将质粒溶液收集到离心管中.
测浓度和含量
嗯, 就是实验仪器的操作.
还是看图吧




后记
这一次图片拍的太少了, 并且我也懒得画, 所以有些不够直观.
总而言之, 感觉生物实验就是一个没有中间运行结果, 没法调试的程序. 虽然很微妙, 但是也还算是好玩.